Santé
Imagerie du vivant : applications en cancérologie et neurosciences

Compétences et prestations
Molécules photoactivables
Élaboration de nouvelles molécules ou nanoparticules photoactivables par la lumière, permettant à la fois la détection de cellules cancéreuses par IRM et leur traitement par PDT
Synthèse par voie enzymatique ou microbienne de nouvelles architectures moléculaires
Criblage de peptides antioxydants, notamment chélateurs de métaux
Evaluations de cinétique
Caractérisations de transfert d’énergie entre molécules en milieu liquide
Mesures de formation d’oxygène singulet
Biophotonique
Instruments d’analyse spectrale, temporelle et spatiale pour l’émission de lumière induite (fluorescence, phosphorescence) ainsi qu’un système d’irradiation destiné aux réactions photochimiques.
Spectroscopie d’absorption UV-Visible
- Spectrophotomètre d’absorption UV visible Perkin Elmer Lambda EZ 210
2 lampes, un monochromateur double faisceaux à réseau concave de type Seya-Namioka et 2 photodiodes au silicium - Spectrophotomètre d’absorption UV visible NIR Shimadzu UV 3600
2 lampes, un monochromateur double réseaux et double faisceaux et 2 détecteurs photomultiplicateur, photodiode InGaAs et détecteur refroidi PbS. Il peut être équipé d’un porte-cuve thermostaté et d’une sphère intégratrice de diamètre 150 mm
- Spectrofluorimètre statique Horiba Jobin Yvon Fluorolog 2
lampe xénon 450 W, monochromateurs d’excitation et d’émission simple réseau (montage en T avec polariseurs), 2 détecteurs PMT R928. Il est possible d’étudier l’anisotropie de fluorescence avec ce montage - Spectrofluorimètre statique Horiba Jobin Yvon Fluorolog 3
lampe xénon 450 W, monochromateurs d’excitation et d’émission double réseaux (montage en T), détecteur PMT R928 et détecteur infrarouge InGaAs permettant l’enregistrement des spectres d’émission d’oxygène singulet dans l’infra-rouge (1270 nm)
- Spectrofluorimètre en temps résolu (PicoQuant GmbH, BERLIN)
Montage de mesure de la durée de vie de fluorescence de l’ordre de la nanoseconde, équipé de 3 diodes laser pulsées émettant respectivement à 407, 466 et 650 nm, d’une galette à microcanaux, d’une photodiode à avalanche et d’un système de comptage monophotonique (module PicoHarp) - Spectrofluorimètre en temps résolu Horiba TEMPRO-01
diode d’excitation pulsée SpectraLED-415 à 415 nm, compartiment porte-cuve, monochromateur d’émission de type Seya-Namioka (600 – 2000 nm), tube photomultiplicateur proche infra-rouge régulé thermoélectriquement H10330-45 (HAMAMATSU, Japon)
Il permet la mesure des durées de vie d’oxygène singulet - Spectrofluorimètre en temps résolu Horiba Fluorolog 3
lampe xénon continue 450 W, lampe flash xénon, compartiment porte-cuve thermostaté (25°C) et photomultiplicateur UV-visible R928 (HAMAMATSU Japon)
Il permet, en plus de la mesure des spectres de fluorescence, la mesure des durées de vie de phosphorescence de l’ordre de la ms ainsi que la mesure du signal de fluorescence décalé par rapport à l’excitation
- Microscope Axiotech (ZEISS) équipé d’une lampe à vapeur de mercure HBO 50 et d’une caméra électronique SENSYS (Photometrics)
- Microscope Axiovert 200 (ZEISS) pouvant recevoir les mêmes équipements que ceux décrits ci-dessus
- En vue de réactions photochimiques, un système d’irradiation qui comporte une lampe à vapeur de mercure Haute Pression (OSRAM HBO 500 W) (émission de raies dans l’UV et le visible) et une lampe plongeante à vapeur de mercure HANAU TNN 15/32, émettant essentiellement à 254 nm
- Divers réacteurs thermostatés permettant l’irradiation, soit sur un faisceau colimaté, soit de façon uniforme dans un cylindre

Monochromateur d’excitation double réseaux – LRGP
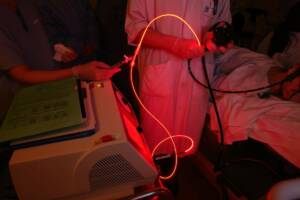
Séance de thérapie photodynamique – CHU Lille
Matériaux et santé connectée
Compétences et prestations
Elaboration de matériaux
Développement de nouveaux nanomatériaux et/ou biomatériaux à architecture et fonctionnalités contrôlées et contrôlables : applications en ingénierie tissulaire, dispositifs médicaux, prothèses, systèmes de vectorisation et de délivrance
Vectorisation de produits actifs : modulation et contrôle de la diffusion d’un produit actif
Développement de capteurs étirables imprimés sur la peau (« tattoo »)
Développement de capteurs aux propriétés piézoélectriques pour le monitoring de la chirurgie
Comportement mécanique
Etude du comportement mécanique des biomatériaux : implants, prothèses
Compatibilité
Etude de la biocompatibilité des matériaux
Etude de la biopersistance, toxicité avec le vivant, stress oxydatif, surcharge cellulaire, immunotoxicité
Synthèse
- Elaboration par chimie douce ou par chimie en solution de matériaux organiques et inorganiques
- Synthèse micro-onde, hydrothermale, par co-précipitation, sol-gel, polyol, par microémulsion de nanoparticules y compris des nanoparticules magnétiques nues ou fonctionnalisées
- Mise en forme des biomatériaux par « solvant casting », « spin coating », « deep coating », « électrospinning », « électrospraying » et par bioimpression 3D/4D
- Elaboration d’organoïdes par différentes techniques dont la bioimpression 3D/4D, les techniques layer-by-layer, les hydrogels
Caractérisation
- Caractérisations multi-échelles, chimiques, physiques, mécaniques et biologiques adaptées aux biomatériaux et nanoparticules
- Détermination des structures par diffraction électronique, rayons X et analyses de surface par photoémission X haute résolution (XPS)
- Etude des propriétés structurales et morphologies des surfaces par microscopie à force atomique (AFM) et mesure des propriétés mécaniques, magnétiques, électriques locales par Spectroscopie champ proche (SCP)
- Etude de la biocompatibilité des matériaux
- Caractérisation de nanoparticules magnétiques multifonctionnelles
- Caractérisation du comportement mécanique
Procédés pharmaceutiques


Compétences et prestations
Bioproduction
Mise en œuvre de procédés de culture de micro-organismes, de cellules animales ou de réactions enzymatiques
Études des contraintes hydrodynamiques et nutritionnelles subies par les cellules animales ou microbiennes en cours de bioprocédés
Développement d’outils de suivi en ligne de bioprocédés
Intensification
Études des changements d’échelle des procédés
Bioréacteurs de volumes variant de 250 mL à 2 L pour les cultures de cellules animales, de 250 mL à 100 L pour les cultures microbiennes et de 500 μL à 2 L pour les réactions enzymatiques.
Bioréacteurs de culture de cellules animales, au sein d’une salle blanche :
- Suivi en-ligne de cultures en fioles : plateforme Khüner à agitation orbitale, le suivi en ligne de l’oxygène dissous et du pH, à l’aide d’outils fluorimétriques présents au cours de cultures en fioles
- Mini-bioréacteurs : 6 bioréacteurs GPC de 250 mL permettant de cribler en parallèle différents environnements nutritionnels et/ou hydrodynamiques, avec des mobiles d’agitation interchangeables
- Bioréacteurs mécaniquement agités : ensemble de bioréacteurs de 2 litres instrumentés pour l’étude de divers procédés de culture
- Suivi en-ligne de cultures en réacteurs : en plus des capteurs classiques (température, pH, oxygène dissous, agitation), les bioréacteurs peuvent être instrumentés avec des sondes à CO2 dissous et des sondes spectroscopiques (capacitance, NIR, RAMAN)
Bioréacteurs de culture microbienne
- Mini-bioréacteurs : plateforme de 6 minibioréacteurs en parallèle (Infors) de 250 mL, pour le criblage et l’optimisation de conditions de culture
- Bioréacteurs mécaniquement agités : bioréacteurs de 1 à 70 litres (GPC, Applikon), pour l’étude de bioprocédés microbiens aérobies et anaérobies. En plus des capteurs classiques, ils peuvent être équipés de sondes à CO2 dissous et d’une analyse en-ligne des gaz par chromatographie gazeuse (SRA ; Shimadzu)
- Bioréacteur air-lift : bioréacteur de 22 litres à agitation pneumatique, développé en interne, dédié à la culture de microorganismes sensibles aux contraintes de cisaillement (Streptomyces sp.,…)
- Bioréacteurs enzymatiques : bioréacteurs de 1 mL à 2 litres
- Réacteurs de synthèse en parallèle : une plateforme de 12 réacteurs agités, thermostatés
- (Radleys) pour le criblage et l’optimisation de réactions enzymatiques (volume de quelques ml) ; une plateforme automatisée de 8 à 16 réacteurs en parallèle (jusqu’à 20 ml), agités, thermostatés (Chemspeed ASW 1000) avec prélèvement automatique et injection en ligne dans un système chromatographique HPLC
- Bioréacteur à micro-ondes (300°C, 80 bar max, 1200 W max, AntonPaar), bioréacteurs à ultrasons de 500 à 700 mL (NexTgen- SinapTec, sonotrode 20 KHz, 5-6 bar max, vitesse d’agitation jusqu’à 3000 trs/min) et bioréacteur sCO2 (Jasco) : réacteurs permettant l’intensification de procédés enzymatiques par l’accroissement des transferts de chaleur ou de matière ou pour développer des procédés continus sans solvant organique
- Micro-bioréacteur : réacteur de 500 µL alimenté par une micro-pompe (HNP), utilisé pour l’intensification de procédés enzymatiques continus utilisant des enzymes immobilisées
Qualité de l'air, aérosols, toxicité des milieux


Compétences et prestations
Caractérisation des aérosols
Caractérisation de la morphologie des particules nanostructurées :
Tailles des particules primaires, nombre de particules primaires par agglomérat, dimension pseudofractale, masse volumique effective…
Étude de l’efficacité de purification
Etude de la filtration des aérosols et des particules nanométriques
Étude des adsorbants et des dynamiques d’adsorption
Toxicité des milieux
Tests d’écotoxicité terrestre (Norme ISO 11268-1 et ISO 11268-2)
Test d’écotoxicité aquatique (Norme ISO 6341 et ISO 10706)
Test génotoxicité (Norme ISO29200) et de mutagénicité (Norme ISO 11350)
Générateurs de particules nanostructurées
Particules nanostructurées métalliques
GFG-1000 (Palas)
Gaz : Argon
Particules: carbone, oxydes métalliques
Concentration > 107 particules/cm3
Débit massique : 0,06 – 6 mg/h
GFG-1000 (Palas)
Gaz: Azote
Particules: carbone, oxydes métalliques
Concentration > 107 particules/cm3
Débit massique: 0,06 – 9 mg/h
Particules de suies
MiniCAST Model 5203 Type C (Jing AG)
Génération de particules de suies par combustion
Débit massique: 30 – 1500 mg/h
Granulométrie: 20 à 200 nm
Générateurs d’aérosols solides
Générateur à brosse tournante : RGB 1000 (Palas) : particules solides (poudre, pollen,…) ; débit massique : 10 – 500 g/h
Disperseur de poudre : BEG 1000C (Palas) : particules solides (poudre, pollen,…) ; débit massique: 350 – 7300 g/h
Générateur de particules solides : AGK 1000 (Palas) : particules solides (NaCl, KCl, agents biologiques, particules en suspension,…) ; granulométrie : 5 nm – 15 μm ; concentration maxi : 107 particules/cm3
Générateurs d’aérosols liquides
Générateur de gouttelettes d’huile : PLG 2000 (Palas) : gouttelettes d’huile (DEHS) ; granulométrie: polydisperse centrée sur 0,4Μm
Générateur de gouttelettes d’huile monodispersées : MAG 2010 (Palas) : gouttelettes d’huile (DEHS) ; granulométrie : monodisperse entre 0,2 -8 μm ; concentration maxi: 106 particules/cm3 ; débit massique: 20 g/h
Bancs d’essai
Bancs instrumentés EOLE I et II pour l’étude de la filtration des aérosols liquides ou solides
Banc d’essai MEFIANCE (Mesure de l’Efficacité des Filtres vis-à-vis des Aérosols Nanométriques Chargés ou Electriquement Neutres) pour l’étude de la filtration de particules nanométriques
Analyse
Mesure de la distribution granulométrique des particules en suspension dans l’air
Détermination de la masse d’un agglomérat/agrégat
Mesure de la concentration totale en particules
Mesure de la charge nette totale sur les particules d’aérosols de 2nm à 5 μm : Electromètre 3068B (TSI)
Neutraliseurs de charges électriques
Neutraliseur électrostatique d‘aérosols avec génération contrôlable d‘ions EAN 581TOPAS
Neutraliseur d’aérosol à rayons X (Aerosol Neutralizer 3088 TSI)
Source radioactive Kr-85
Fluorimètre Victor Nivo 3F
Incubateurs Innova S44i
Cytomètre accuri C6
Retrouvez les autres thèmes d’expertises : ENVIRONNEMENT, MATERIAUX, ENERGIE, ECONOMIE CIRCULAIRE, SANTE, INNOVATION, BIOMOLECULES, NUMERIQUE